Milyen típusú gyógyszer a Remsima - infliximab?
A Remsima gyulladáscsökkentő gyógyszer, amely az infliximab hatóanyagot tartalmazza. Általában, amikor más gyógyszerek vagy kezelések nem hatékonyak, a következő betegségekben szenvedő felnőtteknél alkalmazzák:
- rheumatoid arthritis (az immunrendszer betegsége, amely az ízületek gyulladását okozza). A Remsima-t metotrexáttal (az immunrendszerre ható gyógyszer) együtt alkalmazzák;
- Crohn-betegség (az emésztőrendszer gyulladását okozó betegség), ha a betegség mérsékelt vagy súlyos, vagy fistuláció (fistulák kialakulása, rendellenes átjárók a bél és más szervek között);
- fekélyes vastagbélgyulladás (olyan betegség, amely gyulladást és fekélyeket okoz a bélben);
- ankylozáló spondylitis (olyan betegség, amely gyulladást és fájdalmat okoz a gerinc ízületeiben);
- pszoriázisos ízületi gyulladás (olyan betegség, amely a bőrön vörös pettyes foltok kialakulását és az ízületek gyulladását okozza);
- psoriasis (olyan betegség, amely a bőrön piros pikkelyes foltok kialakulását okozza).
A Remsima-t súlyos Crohn-betegség vagy súlyos aktív fekélyes vastagbélgyulladás kezelésére is alkalmazzák 6 és 17 év közötti betegeknél, akik nem reagáltak vagy nem kezelhetők más gyógyszerekkel vagy terápiákkal. A részleteket lásd a termékjellemzők összefoglalójában (az EPAR-hoz mellékelve). A Remsima egy "biológiailag hasonló" gyógyszer. Ez azt jelenti, hogy a Remsima hasonlít az Európai Unióban (EU) már engedélyezett biológiai gyógyszerhez (a referencia-gyógyszerhez), és hogy a Remsima és a referencia gyógyszer azonos hatóanyagot tartalmaz. A Remsima referencia gyógyszer a Remicade. A biológiailag hasonló gyógyszerekkel kapcsolatos további információkért olvassa el a kérdés- és válaszdokumentumot.
Hogyan alkalmazzák a Remsima - infliximab?
A Remsima por formájában kapható infúziós oldatba (csepegtető), vénába. A gyógyszert csak receptre lehet szerezni, és a kezelést a Remsima által jelzett betegségek diagnosztizálásában és kezelésében jártas szakembernek kell elkezdenie és felügyelnie. A Remsima-t általában 3 mg / ttkg dózisban adják reumatoid arthritisben, bár az adagot szükség esetén növelhetjük. Más betegségek esetén az adag 5 mg / kg. A kezelés ismétlésének gyakorisága a kezelt betegségtől és a betegnek a gyógyszerre adott válaszától függ. A Remsima-t egy-két órás infúzió formájában adják be. Minden beteget monitorozni kell, hogy ellenőrizzék az esetleges reakciókat az infúzió alatt és legalább egy-két órával később. Az infúzióval kapcsolatos reakciók kockázatának csökkentése érdekében a Remsima-kezelés előtt vagy alatt a betegek más gyógyszereket is kaphatnak, vagy az infúzió sebessége lelassulhat. További információ a betegtájékoztatóban található. A Remsima-val kezelt betegeknek speciális figyelmeztető kártyát kell kapniuk, amely összefoglalja a gyógyszer biztonságára vonatkozó információkat.
Hogyan fejti ki hatását a Remsima - infliximab?
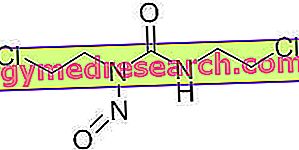
A Remsima hatóanyaga, az infliximab, egy monoklonális antitest, amely egy antitest (egyfajta fehérje), amely a szervezetben jelenlévő specifikus szerkezet (antigén) felismerésére és ahhoz kötődésére alkalmas. Az infliximabot úgy tervezték, hogy a szervezetben lévő kémiai hírvivőhöz kötődjön, úgynevezett alfa-nekrózis faktor (TNF-alfa). Ez a hírvivő részt vesz a gyulladásos folyamatban, és magas szinten található a betegségben szenvedő betegeknél, amelyekre Remsima van feltüntetve. A TNF-alfa blokkolásával az infliximab javítja a gyulladást és más betegség tüneteit. A Remsima-t „rekombináns DNS-technológia” néven ismert módszerrel állítják elő. Az infliximab olyan sejtekből áll, amelyek egy olyan gént (DNS-t) kaptak, amely lehetővé teszi azok előállítását
Milyen előnyei voltak a Remsima - infliximab alkalmazásának a vizsgálatok során?
A Remsima-t azért vizsgálták, hogy igazolja a összehasonlíthatóságát a Remicade referencia-gyógyszerrel. A Remsima-t a Remicade-szel hasonlították össze egy fő vizsgálatban, melyben 606 felnőtt vett részt rheumatoid arthritisben. A betegeket Remsima-val vagy Remicade-vel kezelték a metotrexát mellett 30 hétig. A hatékonyság fő mércéje a tünetek változása volt. 30 hetes kezelés után a Remsima Remicade-ként volt hatásos, a betegek körülbelül 60% -a reagált a kezelésre.
További vizsgálatot végeztek 250 ankylopoetilitisben szenvedő betegnél annak kimutatására, hogy a Remsima a hatóanyag szintjét a Remicade referencia-gyógyszeréhez hasonlítja.
Milyen kockázatokkal jár a Remsima - infliximab alkalmazása?
A Remsima leggyakoribb mellékhatásai (10-ből több mint 1 betegnél) a vírusfertőzések (pl. Influenza vagy hideg sebek), fejfájás, felső légúti fertőzés (megfázás), sinusitis (a sinus gyulladása), hányinger., hasi fájdalom (gyomorfájás), infúzióval kapcsolatos reakciók és fájdalom. Egyes mellékhatások, köztük a fertőzések, gyakoribbak lehetnek gyermekeknél, mint a felnőtteknél. A Remsima-val kapcsolatban jelentett mellékhatások teljes listáját lásd a betegtájékoztatóban. A Remsima nem alkalmazható olyan betegeknél, akik túlérzékenyek (allergiásak) az infliximabdal szemben, vagy akik túlérzékenyek (allergiásak) az egérfehérjékkel vagy a Remsima bármely más összetevőjével szemben. A Remsima nem alkalmazható tuberkulózisban szenvedő betegeknél, egyéb súlyos fertőzéseknél vagy közepesen súlyos vagy súlyos szívelégtelenségben (a szív képtelensége ahhoz, hogy elegendő vért pumpáljon a szervezetbe).
Miért engedélyezték a Remsima - infliximab forgalomba hozatalát?
Az Ügynökség emberi felhasználásra szánt gyógyszerek bizottsága (CHMP) úgy döntött, hogy az EU követelményeivel összhangban a Remsima kimutatta, hogy összehasonlítható minőségi, biztonsági és hatásossági profilja van a Remicade-nak. Ezért a CHMP úgy ítélte meg, hogy - mint a Remicade esetében is - az előnyök meghaladják az azonosított kockázatokat, és javasolta a Remsima használatának jóváhagyását az EU-ban.
Milyen intézkedéseket hoznak a Remsima - infliximab biztonságos és hatékony használatának biztosítása érdekében?
Kockázatkezelési tervet dolgoztak ki annak biztosítása érdekében, hogy a Remsima a lehető legbiztonságosabb legyen. E terv alapján a Remsima termékjellemzői és a betegtájékoztató tartalma tartalmazza a biztonsági információkat, beleértve az egészségügyi szakemberek és a betegek által követendő megfelelő óvintézkedéseket. Továbbá, a Remsima-t forgalmazó vállalat tájékoztató anyagot fog nyújtani az orvosok számára, akik a gyógyszert felírják a felnőttek és gyermekek számára, beleértve a gyógyszer biztonságosságára vonatkozó információkat és a betegeknek adandó figyelmeztető kártyát. A vállalat tanulmányokat is készít a gyógyszer hosszú távú biztonságának megerősítésére.
További információ a Remsima - infliximabról
2013. szeptember 10-én az Európai Bizottság kiadta a Remsima forgalomba hozatali engedélyét, amely az Európai Unió egész területén érvényes. A Remsima-ra vonatkozó teljes EPAR az Ügynökség honlapján található: ema.Europa.eu/Find medicine / Emberi gyógyszerek / Európai nyilvános értékelő jelentések. A Remsima-val történő kezeléssel kapcsolatos további információkért olvassa el a (szintén az EPAR részét képező) betegtájékoztatót, vagy forduljon orvosához vagy gyógyszerészéhez. Az összefoglaló utolsó frissítése: 09/2013