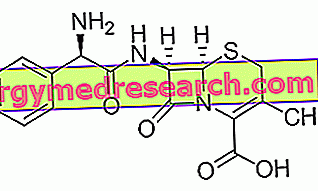
A húsz aminosavról, amelyek a fehérjét és a módosított szerkezeteket tartalmazzák, legalább tizenkét speciális metabolikus útvonalat kell leírni.
De miért használják a sejtek annyi metabolikus útvonalat, amely energiát igényel (például az enzimek katalitikus helyeinek regenerálására), amelyek mindegyike enzimatikus örökséggel rendelkezik az aminosavak katabolálására? Szinte az összes aminosavat speciális útvonalakon lehet beszerezni, olyan metabolitokat, amelyek kis részben energiát termelnek (például glükoneogenezis és a keton testek útja), de amelyek mindenekelőtt összetett molekulák képződéséhez vezetnek, nagy számú szénatommal (például fenilalaninból és tirozinból, hormonok termelődnek az erre a célra specializált mellékvesékben); ha egyrészt könnyű lenne az aminosavakból előállítani az energiát, másrészt bonyolult lenne a kis molekulákból kiindulva összetett molekulákat építeni: az aminosavak katabolizmusa lehetővé teszi számunkra, hogy a csontvázukat nagyobb fajokhoz kapjuk.
Két vagy három uncia aminosavat naponta egy egészséges személy bomlik le: 60-100 g, az étrend által bevitt fehérjékből származik, de több mint 2 uncia nyerhető a szervezet szerves részét képező fehérjék normál forgalmából (aminosavak) ezekből a fehérjékből, amelyeket a redox folyamatok károsítanak, mások helyettesítik és katabolizálják).
Az aminosavak energiát adnak az ATP-ben: az a-aminocsoport eltávolítása után az aminosavak megmaradt szénváza a megfelelő átalakulásokat követően beléphet a krebs ciklusba. Továbbá, amikor a tápanyagellátás hiányzik, és a glükóz mennyisége csökken, a glükoneogenezis aktiválódik: a glükoneogenetikus aminosavakat úgy nevezik, hogy a megfelelő módosításokat követően be lehet vezetni a glükoneogenezisbe; glükoneogenetikus aminosavak azok, amelyeket piruváttá vagy fumaráttá alakíthatunk (a fumarátot a mitokondriumokból kilépő betegekké alakíthatjuk, és a citoplazmában oxaloacetátokká alakítjuk, amelyből foszfoenol nyerhető). Ehelyett az acetil-koenzim-A-ra és ecet-acetáttá alakítható ketogén aminosavak.
A fent leírtak egy nagyon fontos szempont, mivel az aminosavak azonnali böjt esetén orvosolhatják a cukorhiányt; ha éhgyomri fennmarad, a lipid anyagcsere két nap múlva lép fel (mivel a fehérjeszerkezetek nem sokat támadhatnak), ebben a fázisban, mivel a glükoneogenezis nagyon korlátozott, a zsírsavak acetil-koenzim-A és keton-testekké alakulnak . A további böjtölés óta az agy alkalmazkodik a keton testekhez.
Az a-aminocsoport aminosavakból történő transzferálása transzaminációs reakción keresztül történik; ezt a reakciót katalizáló enzimeket transzaminázoknak (vagy amino-transzferázoknak) nevezik. Ezek az enzimek piridoxál-foszfát nevű enzimatikus kofaktorot alkalmaznak, amely az aldehid-csoportjába lép. A piridoxál-foszfát a piridoxin foszforilációjának eredménye, amely főleg zöldségekben található (B6) vitamin.
A transzaminázok a következő tulajdonságokkal rendelkeznek:
Magas specifitás az a-ketoglutarát-glutamát párra;
Nevezik a második párból.
A transzamináz enzimek mindig magukban foglalják az a-ketoglutarát-glutamát párot, és a második pár is megkülönböztethető.
Példák:
Aspartát transzamináz vagy GOT (glutamát-oxál-acetát transzamináz): az enzim az α-aminocsoportot aszpartátból α-ketoglutaráttá alakítja át, oxalacetátot és glutamátot kapva.
Alanin transzamináz, azaz GTP (glutamát-piruvát transzamináz): az enzim az α-aminocsoportot alaninból a-ketoglutaráttá alakítja át, piruvátot és glutamátot kapva.
A különböző transzaminázok az α-ketoglurátot használják az aminosavak amino-csoportjának akceptoraként és glutamáttá alakítják; míg a képződött aminosavak a keton testek útjában használatosak.
Ez a fajta reakció mindkét irányban megtörténhet, mivel eltörnek, és az azonos energiájú kötések keletkeznek.
A transzaminázok mind a citoplazmában, mind a mitokondriumokban vannak (ezek többnyire aktívak a citoplazmában) és izoelektromos pontjukban különböznek.
A transzaminázok képesek aminosavak dekarboxilezésére is.
A glutamátot α-ketoglutaráttá kell átalakítani: ez deaminációval történik.
A glutamát-dehidrogenáz olyan enzim, amely képes glutamátot α-ketoglutaráttá alakítani, és így a glutamát formájában található aminosavak aminosavainak ammóniává történő átalakítására. Az történik, hogy egy oxidoreduktív folyamat folyik át a közbenső α-amino-glutáráton: az ammónia és az α-ketoglutarát szabadul fel, és visszatér a keringésbe.
Így az aminosavak aminocsoportjainak elhelyezése áthalad a transzaminázokon (a szubsztráttól függően) és a glutamát-dehidrogenázon, amely meghatározza az ammónia képződését.
Kétféle glutamát-dehidrogenáz van: citoplazmatikus és mitokondriális; a kofaktor, amely szintén az enzim együttes alkotórésze, a NAD (P) +: a glutamát dehidrogenáz NAD + vagy NADP + -ot használ a redukáló teljesítmény akceptoraként. A citoplazmatikus forma előnyben részesíti, bár nem kizárólagosan, a NADP + -ot, míg a mitokondriális forma előnyben részesíti a NAD + -ot. A mitokondriális forma célja az aminocsoportok elhelyezése: az ammónia kialakulásához vezet (ami a mitokondriumok speciális enzimének szubsztrátja) és a NADH (amely a légzési láncba kerül). A citoplazmatikus forma ellentétes irányban működik, azaz ammóniát és α-ketoglutarátot használ, hogy glutamátot kapjon (amely bioszintetikus célpont): ez a reakció egy reduktív bioszintézis és a használt kofaktor NADPH.
A glutamát-dehidrogenáz akkor működik, amikor az aminosavak aminosavcsoportjait, például az ammóniát (vizelettel) el kell dobni, vagy ha az aminosavak csontvázai szükségesek az energia előállításához: ez az enzim ezért olyan rendszereket tartalmaz, amelyek negatív modulátorokként jelzik a jó energia rendelkezésre állást (ATP). GTP és NAD (P) H) és pozitív modulátorok, amelyek energiaigényt jeleznek (AMP, ADP, GDP, NAD (P) +, aminosavak és pajzsmirigy hormonok).
Az aminosavak (főként leucin) a glutamát-dehidrogenáz pozitív modulátorai: ha a citoplazmában aminosavak vannak jelen, akkor ezek felhasználhatók a fehérjeszintézishez, vagy el kell dobni, mert nem lehet felhalmozódni (ez magyarázza, hogy az aminosavak pozitív modulátorok) .
Ammónia elhelyezés: karbamid ciklus
A halak ammóniát ártalmatlanítanak a vízbe a gilleken keresztül; a madarak húgysavvá alakítják át (amely kondenzációs termék), és ürülékkel kiküszöböli. Lássuk, mi történik az emberekben: azt mondtuk, hogy a glutamát-dehidrogenáz a glutamátot α-ketoglutaráttá és ammóniává alakítja, de nem mondtuk, hogy ez csak a máj mitokondriumában történik.
Az ammónia elhelyezésének alapvető szerepét a karbamid cikluson keresztül a mitokondriális transzaminázok fedezik.

a szén-dioxidot hidrogén-karbonát-ion (HCO3-) formájában aktiválja a biotin kofaktor, amely a karboxi-biotint képezi, amely ammóniával reagál a karbaminsav előállítására; az ezt követő reakció ATP-t használ a foszfát karbaminsavba történő átvitelére, ami karbamil-foszfátot és ADP-t képez (az ATP átalakítása ADP-ként a karboxibiotin megszerzésének hajtóereje). Ezt a fázist a karbamil-foszfát-szintetáz katalizálja, és a mitokondriumokban fordul elő. A karbamil- foszfát és az ornitin az ornitin-transz-karbamiláz enzim szubsztrátja, amely citrullinná alakítja őket; ez a reakció a mitokondriumokban (hepatocitákban) fordul elő. A keletkezett citrulin a mitokondriumokból származik, és a citoplazmában az arginin szukcinát szintáz hatására megy végbe: a citrulin szénváza és az aszpartát egy nukleofil támadás és a későbbi víz eltávolítása révén fúziója van. Az arginin-szukcinát-szintáz enzim ATP-molekulát igényel, ezért van egy energetikai kapcsolás: az ATP hidrolízise az AMP-re és a pirofoszfáttá (ez utóbbi két ortofoszfát-molekulává alakul) molekula kiürítésével a vízből a szubsztrátból, és nem a közegben lévő víz hatására.
A következő enzim az arginin-szukcináz : ez az enzim képes az arginin-szukcinátot a citoplazmában argininné és fumaráttá osztani.
A karbamid ciklust az argináz enzim végzi : a karbamidot és az ornitint kapjuk; A karbamidot a vesék (vizelet) ártalmatlanítják, míg az ornitin visszatér a mitokondriumokba, és folytatja a ciklust.
A karbamidciklus arginin közvetett modulációnak van kitéve: az arginin felhalmozódása azt jelzi, hogy fel kell gyorsítani a karbamid ciklust; Az arginin moduláció közvetett, mivel az arginin pozitívan modulálja az acetil-glutamát szintetáz enzimet. Ez utóbbi egy acetilcsoportot képes átjuttatni egy glutamát nitrogénjébe: N-acetil-glutamát képződik, amely a karbamil-foszfo-szintetáz enzim közvetlen modulátora.
Az arginin a karbamid-ciklus metabolitjaként halmozódik fel, ha a karbamil-foszfát előállítása nem elegendő az ornitin eltávolításához.
A karbamid csak a májban keletkezik, de vannak más helyek is, ahol kezdeti reakciók lépnek fel.
Az agy és az izmok speciális stratégiákat alkalmaznak az aminocsoportok eltávolítására. Az agy egy nagyon hatékony módszert alkalmaz, amelyben egy glutamin szintetáz enzimet és egy glutamáz enzimet használnak: az előbbi neuronokban van jelen, míg az utóbbi a májban található. Ez a mechanizmus két okból nagyon hatékony:
Két amino-csoportot szállítunk az agyból a májba csak egy járművel;
A glutamin sokkal kevésbé mérgező, mint a glutamát (a glutamát neuron transzfert is hordoz, és nem haladhatja meg a fiziológiai koncentrációt).
A halakban egy hasonló mechanizmus hozza az aminosavak amino-csoportját a gillekbe.
Az izomtól (csontváz és szív) az aminocsoportok a glükóz-alanin cikluson keresztül jutnak a májba; a szóban forgó enzim glutamin-piruvát transzamináz: lehetővé teszi az aminocsoportok (amelyek glutamát formájában vannak) transzponálását, a piruvát alaninná és egyidejűleg a glutamáttá az izomban a-ketoglutaráttá történő átalakításában, és az inverz folyamat katalizálásával máj.
A különböző feladatokkal vagy pozíciókkal rendelkező transzaminázok szerkezeti különbségekkel is rendelkeznek, és elektroforézissel határozhatók meg (különböző izoelektromos pontok).
A transzaminázok jelenléte a vérben máj- vagy kardiopatikus károsodás tünete lehet (azaz a máj- vagy szívsejtek károsodása); A transzaminázok igen magas koncentrációban vannak mind a májban, mind a szívben: elektroforézissel megállapítható, hogy a károsodás májban vagy szívsejtekben történt.