Mi az a Fabrazyme?
A Fabrazyme egy intravénás infúzió (vénába csepegtető) oldat, amely az agalsidáz béta hatóanyagot tartalmazza.
Milyen betegségek esetén alkalmazható a Fabrazyme?
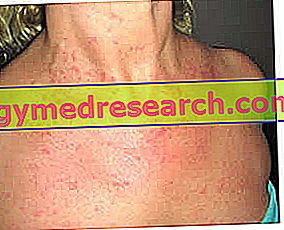
A Fabrazyme-t Fabry-betegségben szenvedő betegek, ritka örökletes állapot kezelésére alkalmazzák. Az e betegségben szenvedő betegek az alfa-galaktozidáz A. enzim hiányát mutatják. Ez az enzim általában lebontja a lipid globotriaozilceramidot (GL-3). Ha ez az enzim hiányos, a GL-3 nem bontható le és nem halmozódik fel a szervezet sejtjeiben, például a vesesejtekben.
Ennek a betegségnek a tünetei széles körűek, beleértve a súlyos rendellenességeket, mint például a veseelégtelenség, a szívproblémák és a stroke.
Tekintettel az e betegségben szenvedő betegek kis számára, azt „ritkanak” tekintették, és 2000. augusztus 8-án a Fabrazyme-et „ritka betegségek gyógyszere” -nek (ritka betegségek kezelésére használt gyógyszer) írták le.
A gyógyszer csak receptre kapható.
Hogyan alkalmazzák a Fabrazyme-t?
A Fabrazyme-t csak a Fabry-betegségben szenvedő betegek vagy más örökletes anyagcsere-betegségek kezelésében jártas orvos állapíthatja meg. A Fabrazyme adagja 1 mg testtömeg-kilogrammonként, két hetente egyszer, intravénás infúzió formájában. Az infúzióval kapcsolatos reakciók kockázatának csökkentése érdekében a kezdeti infúzió sebessége nem haladhatja meg a 0, 25 mg-ot percenként (15 mg / óra). A következő infúziókban az infúziós sebesség fokozatosan növelhető. Az egyik vizsgálatban a Fabrazyme-ot gyerekeknek adták, és arra a következtetésre jutottak, hogy a gyógyszert ugyanazon dózisban 8–16 éves korú gyermekek számára lehet adni. Súlyos vesekárosodásban szenvedő betegek kevésbé reagálhatnak a kezelésre. A Fabrazyme-ot hosszú távú alkalmazásra szánják.
Hogyan fejti ki hatását a Fabrazyme?
A Fabrazyme lehetővé teszi az enzim-helyettesítő kezelés megvalósítását. Ez a fajta terápia a betegek számára hiányzik az enzim. A Fabrazyme az alfa-galaktozidáz A enzim helyettesítésére szolgál, amelyet a Fabry-betegségben szenvedők nem rendelkeznek. A Fabrazyme hatóanyaga a béta agalzidáz, a rekombináns DNS-technológiával ismert módszerrel előállított enzim emberi formájának egy példánya: az enzimet olyan sejt termeli, amelybe egy gént bevittek (DNS). amely lehetővé teszi annak létrehozását. Ez a helyettesítő enzim elősegíti a GL-3 lebomlását és megakadályozza annak felhalmozódását a beteg sejtjeiben.
Milyen vizsgálatokat végeztek a Fabrazyme alkalmazásával?
Három klinikai vizsgálatot végeztünk 73 felnőtt beteg bevonásával. A fő vizsgálatban a Fabrazyme-t 58 betegnél hasonlították össze placebóval (hatóanyag nélküli kezeléssel), mérve a gyógyszer hatását a GL-3 eliminációjára a vesesejtekből.
A Fabrazyme hatásosságát 16, 8 és 16 év közötti Fabry-betegségben szenvedő gyermeknél is megvizsgálták.
Milyen előnyei voltak a Fabrazyme alkalmazásának a vizsgálatok során?
A fő vizsgálatban a Fabrazyme a GL-3-ot a veséksejtekből nagyon jelentősen, majdnem 20 héttel a kezelés után szinte befejezte. A Fabrazyme-val kezelt betegek 69% -a volt a legjobb lipid eliminációs szint, szemben a placebo csoportban talált null hatásokkal. Ez a tünetek javulásához vagy a betegség stabilizálásához vezethet.
Még a Fabrazyme-val kezelt gyermekeknél a vér GL-3 szintjének csökkenése is megfigyelhető volt, és minden gyermek normális szintet ért el 20 hetes kezelés után. Emellett javult a gyermekek tünetei és életminősége.
Milyen kockázatokkal jár a Fabrazyme alkalmazása?
A vizsgálatok során a Fabrazyme leggyakoribb mellékhatásai (10 beteg közül több mint egynél) az infúzió, nem pedig maga a gyógyszer okozta. A leggyakoribb reakciók a láz és hidegrázás. Egyéb gyakori mellékhatások: fejfájás, paraesthesia (rendellenes érzések, mint bizsergés és bizsergés), hányinger, hányás, bőrpír és hideg érzés. A gyermekeknél észlelt mellékhatások hasonlóak voltak a felnőtteknél tapasztaltakhoz. A Fabrazyme alkalmazásával kapcsolatban jelentett összes mellékhatás teljes felsorolását lásd a betegtájékoztatóban.
A Fabrazyme-t szedő betegek antitesteket hozhatnak létre (a Fabrazyme-ra adott reakcióként előállított fehérjék, amelyek befolyásolhatják a kezelést).
A Fabrazyme nem alkalmazható olyan személyeknél, akik túlérzékenyek (allergiásak) lehetnek a béta agalsidázzal vagy a gyógyszer egyéb összetevőivel.
Miért engedélyezték a Fabrazyme forgalomba hozatalát?
Az emberi felhasználásra szánt gyógyszerek bizottsága (CHMP) úgy ítélte meg, hogy a Fabry-betegségben szenvedő betegeknél a Fabrazyme-kezelés hosszú távú klinikai előnyökkel járhat. A CHMP úgy ítélte meg, hogy a Fabrazyme előnyei meghaladják a hosszú távú enzimhelyettesítő kezelés kockázatát a Fabry-betegség megerősített diagnózisában szenvedő betegeknél, ezért javasolta a forgalomba hozatali engedély kiadását.
A Fabrazyme-t kezdetben kivételes körülmények között engedélyezték, mivel ritka betegség kezelésére használták a jóváhagyás időpontjában rendelkezésre álló adatokat.
Mivel a gyártó benyújtotta a kért kiegészítő információkat, a „kivételes körülményekre” vonatkozó feltétel 2008. február 6-án megszűnt.
További információ a Fabrazyme-ről
2001. augusztus 3-án az Európai Bizottság megadta a Fabrazyme forgalomba hozatali engedélyét a Genzyme Europe BV-nek, amely az Európai Unió egész területén érvényes. 2006. augusztus 3-án az engedélyt megújították.
A Fabrazyme ritka betegségek gyógyszereinek státuszának regisztrálása itt érhető el.
Az értékelés teljes változata (EPAR) itt érhető el.
Az összefoglaló utolsó frissítése: 02 - 2008