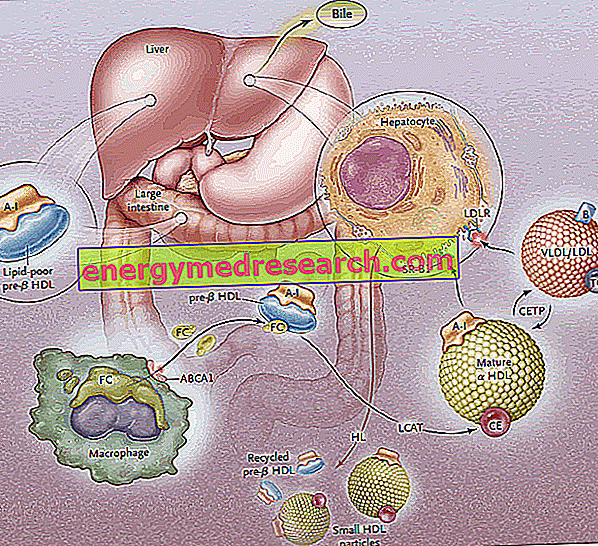
A fordított koleszterin-transzport (RCT) az a folyamat, amely során a koleszterint eltávolítják a perifériás szövetekből, a HDL lipoproteinekbe való beépítésével és az ezt követő, a májba történő elszállításával.
A perifériás sejtek, mint minden nem-bél- vagy májsejt, nem képesek a koleszterin feleslegének lebontására; ezért a sejtek homeosztázisának fenntartásához elengedhetetlen a koleszterin sejtekből történő eltávolítására szolgáló mechanizmus jelenléte. Ezt a mechanizmust, melynek célja a perifériás koleszterin feleslegének károsodása, "fordított koleszterin-transzportnak" nevezzük (RCT: fordított koleszterin-transzport ).
Vizsgáljuk meg részletesen a folyamatot.
A HDL lipoproteinek bioszintézise a fő fehérje komponensek (apoproteinek) szintézisén és kezdeti szekrécióján keresztül megy végbe, ezt követi a lipidek (foszfolipidek és koleszterin) extracelluláris felvétele, ami érett HDL részecskék összegyűjtéséhez és generálásához vezet.
A fordított koleszterin-transzport első szakasza a HDL diszkoid prekurzorainak termelését jelenti a bélben és a májban, amelyek felületükön apoproteineket (főleg ApoA-I) tesznek ki; így a pre-B-HDL nevű HDL prekurzor molekulái szabadulnak fel, amelyek nagyon kis mennyiségű koleszterint és lipidet, különösen foszfolipideket tartalmaznak. Ezeknek a prekurzor molekuláknak a perifériás szinten történő jelenléte elősegíti a perifériás szöveti sejtekből kilépő szabad szabad koleszterin (FC) áteresztését apo AI-re egy ATP-kötő kazetta A1-nek nevezett membrán transzporter (ABCA1) segítségével. ). Ez a transzporter a sejtfelületen és a Golgi membránokon helyezkedik el, és a lipideket a Golgi készülékről a sejtmembránra szállíthatja, elősegítve azok kiáramlását. Ezen a ponton, amint a szabad koleszterin belép a natív HDL-ekbe, egy plazma enzim, amely a májból származik, úgynevezett plazma lecitin-koleszterin acil-transzferáz, vagy egyszerűen csak LCAT; ez az enzim átalakítja a pre-B-HDL-be beépített szabad koleszterint koleszterin-észterekké, átalakítva a pre-B-HDL-t érett α-HDL formájukba; a gyakorlatban a koleszterin folyamatos felhalmozódása a lipoprotein magban a discoid HDL-t gömb és szemcsés részecskékké alakítja át, amelyek tovább képesek a trigliceridekben gazdag lipoprotein részecskékből származó apoproteinek megszerzésére. A teljes folyamatban az apolipoprotein AI kulcsszerepet játszik, s mind az ABCA1 transzporter, mind az LCAT aktivitását stimulálja. Mivel az ApoAI a legszélesebb körben képviselt apolipoprotein a HDL-ben, plazma koncentrációja közvetlenül kapcsolódik a HDL koleszterin szintjéhez.
FIGYELEM: az észterezési folyamat alapvető fontosságú a koleszterin HDL-ről a plazmamembránra történő újraelosztásának megakadályozására; ez a mechanizmus kihasználja a foszfatidil-kolin molekulákban jelen lévő második helyzetben lévő zsírsavat.
Az LCAT által közvetített észterezési eljárás ezután a pre-B-HDL molekulákat "érett" α-HDL gömb alakúvá alakítja. Ezeket a lipoproteineket ezután a májba juttatják, ahol két különböző módon szabadítják fel a koleszterint.
Az első esetben az észterezett koleszterinben gazdag HDL ezt a lipidet trigliceridekben gazdag lipoproteinekhez (nagyon alacsony sűrűségű és kis sűrűségű lipoproteinek) eredményezi, majd a májban specifikus receptorokon (LDL-R) keresztül fogják be, és eltávolítják a keringésből. A cél a perifériás koleszterin átjutása a májba az LDL receptorrendszeren keresztül, majd a HDL eltávolítása a felesleges koleszterinről a perifériás szintre, hogy újra hozzáférhetővé váljon a szövetekből történő befogadására; a koleszterin kiürítése, a HDL-ek átváltják a triglicerideket, és ez a koleszterin-észter transzfer fehérje (CETP) révén történik. E fehérje feladata ezért a koleszterin-észterek és trigliceridek újraelosztása és egyensúlyának elősegítése a HDL, LDL, IDL, VLDL, chilomikron és chilomikron lipoproteinek között, ami nettó eredményként a gazdagodáshoz vezet. HDL-trigliceridek, a koleszterin-észterek kárára és a HDL-méret csökkenése.
A második út magában foglalja a HDL észterezett koleszterinben gazdag SRL B1 receptorait, a HDL fehérje részének egyidejű lebomlása nélkül, amelyet ezután újrahasznosítanak. A gyakorlatban ez az enzim lehetővé teszi, hogy kiürítse a HDL-eket a tartalmukból, és újjáépítse az új pre-B-HDL-eket. A HDL és az ApoA-I egy része azonban internalizálódik és lizoszomális szinten lebomlik, mind a májban, mind a vesében. Az SR-B1 által közvetített felvétel hatékonyabbá válik a máj lipáz aktivitásával, amely képes felújítani a HDL-eket a felszíni foszfolipidek hidrolizálásával, és lehetővé teszi az észterezett koleszterin áramlását a lipoprotein magból a plazmamembrán felé (feltételezhető, hogy az más, hogy az ApoE is részt vesz a szelektív felvételben, mivel az ApoE génre hiányos egerek csökkentik az útvonal hatékonyságát. Az SR-BI főleg a májban, a mellékvesékben és a petefészekben expresszálódik.