Mi az a Beromun?
A Beromun port és oldószert tartalmaz infúziós oldat elkészítéséhez. Tartalmazza a tasonermin hatóanyagot.
Milyen betegségek esetén alkalmazható a Beromun?
A Beromun-t a végtagok lágyszövet-szarkóma (tumorfajtája) melfalánnal (rákellenes gyógyszer) kombinálva alkalmazzák, a „lokoregionális végtag-perfúzió” (ILP) alkalmazásával: mindkét gyógyszert a végtag, míg a helyi vérkeringést a test többi részétől elkülönítve tartják. Ezt a technikát használhatjuk a műtét előtt a tumor tömegének csökkentésére vagy a műtét helyettesítésére, ha a műtét önmagában nem elegendő a tumor eltávolításához.
A gyógyszer csak receptre kapható.
Hogyan kell alkalmazni a Beromun-t?
A Beromun-kezelést csak speciális központokban, az ilyen típusú daganatok kezelésére szakosodott sebészcsoportok és a lokoregionális végtag perfúzió technikájában végezhetik. Ezekben a központokban mindig rendelkezésre kell állnia az intenzív osztályon, ahol a berendezés a test többi részében a gyógyszer elvesztésének folyamatos monitorozására szolgál, radioaktív nyomjelzők segítségével.
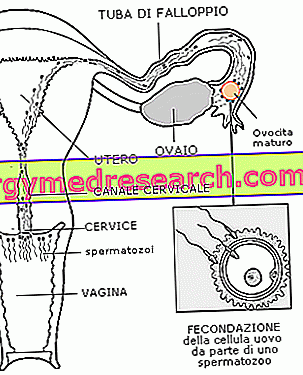
A Beromun beadása előtt a végtagot el kell különíteni: az általános érzéstelenítésben szenvedő páciensnek szoros csipkét kell alkalmazni az érintett végtag felől, annak érdekében, hogy elkülönítse a vérellátást és megakadályozza, hogy a gyógyszer belépjen a keringésbe szisztémás (általános). A végtag vérkeringését ezután egy speciális folyadék "perfúziójával" helyettesítik, és a végtagot 38 ° és 39 ° közötti hőmérsékletre melegítik. Később a Beromun injekciót a perfúziós oldatba 3 mg dózisban adjuk be egy karnak és 4 mg-ot egy lábnak 90 perc alatt. A melfalánt egyidejűleg 60 percen belül, a Beromun önmagában történő 30 perces perfúzióját követően adják be, amikor a hőmérsékletet 39-40 ° C-ra kell növelni. A malphalan adagja a kar vagy a láb méretétől függ. A perfúzió végén (azaz 90 perc elteltével) a gyógyszert egy speciális mosófolyadék segítségével extraháljuk a végtagból. Ha csak lehetséges (általában néhány hét után), a maradék tumor műtéti eltávolítását kell végezni.
A Beromun-t általában csak egyszer használják. Szükség esetén a második perfúziót 6-8 héttel az első kezelés után végezhetjük el. A Beromun alkalmazása 18 évesnél fiatalabb betegeknél nem javasolt, mivel nincs információ a termék biztonságosságáról és hatásosságáról ebben a korcsoportban.
Hogyan fejti ki hatását a Beromun?
A Beromun hatóanyaga, a tasonermin, a humán fehérje, más néven tumor nekrózis faktor alfa1a (TNFα), egy példánya. A TNFα pontos hatásmechanizmusa bizonyos ráktípusok ellen nem teljesen ismert, de úgy vélik, hogy képes közvetlenül eltávolítani a rákos sejteket és elpusztítani a tumor tömegét biztosító ereket, serkenteni a rendszert. immunis a támadásra. Ily módon a tumor regressziója és mérete csökken, különösen akkor, ha a gyógyszer más citotoxikus szerekkel (azaz képes a sejtek megsemmisítésére) és a hőmérséklet emelkedéséhez vezet.
A Beromun, tasonermin hatóanyagát "rekombináns DNS-technológia" néven ismert módszerrel állítják elő, azaz olyan baktériumokból nyerik, amelyekben egy olyan gént (DNS-t) vezettek be, amely lehetővé teszi számukra a TNFa előállítását. A szintetikus TNFα a természetes eredetű fehérje.
Milyen tanulmányokat végeztek a Beromun-on?
A Beromun-t négy fő vizsgálatban tanulmányozták, összesen 188 beteg bevonásával, akiknek a gyógyszert melfalánnal kombinálva adták. Emellett 62 beteg kapott gamma-interferont (egy másik rákellenes gyógyszert). A három független szakértő által végzett vizsgálatok áttekintése azt mutatta, hogy e betegek csak 145-e volt a daganat amputálására vagy sebészeti eltávolítására, ami a funkció jelentős csökkenéséhez vezetett (fogyatékosság). Ezért a hatékonyság fő mércéje a terápia kimenetelének értékelése szakértők által, ezeknek a 145 betegnek a becsült kimeneteléhez képest, ha a Beromun-t nem használták.
Milyen előnyei voltak a Beromun alkalmazásának a vizsgálatok során?
A független szakértők egyetértettek abban, hogy a Beromun-val és a melfalánnal kezelt betegek 62% -a (145-ből 90-nél) jobb eredményt ért el, minthogy a végtagot meg lehetett menteni anélkül, hogy a műtétet eltávolították volna daganat vagy eltávolítja a daganatot anélkül, hogy jelentős funkcionális veszteséget okozna. A gamma-interferonnal kezelt betegek száma nem volt elegendő annak megállapításához, hogy ez a kezelés tovább javította-e vagy sem a terápiás eredményt.
Milyen kockázatokkal jár a Beromun alkalmazása?
A legtöbb Beromun-val kezelt beteg lázzal jár, általában enyhe vagy mérsékelt. Egyéb nagyon gyakori mellékhatások (10 beteg közül több mint 1 betegnél) a fertőzés, a szívritmuszavar (a normális szívritmus megváltozása), hányinger, hányás, májkárosodás, fáradtság, hidegrázás, végtagfájdalom, idegkárosodás, bőrreakciók, ödéma (duzzanat) és fertőzés a seben. A Beromun egyes mellékhatásai súlyosak és szükségessé tehetik az intenzív osztályba történő áthelyezését a kezelés után. A Beromun alkalmazásával kapcsolatban jelentett összes mellékhatás teljes felsorolását lásd a betegtájékoztatóban.
A Beromun nem alkalmazható olyan személyeknél, akik túlérzékenyek (allergiásak) lehetnek a tasonerminnel vagy a készítmény bármely más összetevőjével szemben. Nem adható súlyos szív- és érrendszeri betegségekben (szív- és érrendszeri megbetegedésekben) szenvedő betegeknél, súlyos tüdőbetegséggel, közelmúltban kóros fekélyrel vagy aktív peptikus fekélygel, súlyos ascites formákkal (folyadékgyűjtés). a hasüregben), a vérváltozások, a vesékben vagy a májban szenvedő betegségek, vagy a hiperkalcémia (a vér kalciumszintjének növekedése), illetve a terhes vagy szoptató nők esetében. Nem adható olyan betegeknek is, akik ellenjavallt a vazopresszoros gyógyszerek (vérnyomásnövelő gyógyszerek), antikoagulánsok (gyógyszerek, amelyek a vér képtelenné válnak) vagy gyógyszerek, amelyek károsíthatják a szívet. . A Beromun nem alkalmazható olyan betegeknél, akiknél a melfalán alkalmazása nem ellenjavallt, vagy akik nem végezhetnek ILP-t. További részletekért olvassa el az EPAR-ban található készítményt.
Miért engedélyezték a Beromun forgalomba hozatalát?
Az emberi felhasználásra szánt gyógyszerek bizottsága (CHMP) úgy döntött, hogy a Beromun előnyei meghaladják a daganatot eltávolító műtéti terápia kiegészítő terápiáját, a végtag amputációjának megelőzése vagy késleltetése érdekében, vagy palliatív terápia a végtagok nem működő lágy szöveti szarkómainak jelenlétében, melfalánnal kombinálva a végtag mérsékelt hipertermikus lokoregionális perfúziójához (ILP). A bizottság ezért javasolta a termék forgalomba hozatali engedélyének megadását.
További információ a Beromunról
1999. április 13-án az Európai Bizottság a Beromunra vonatkozóan kiadta az Európai Unió egész területén érvényes forgalomba hozatali engedélyt a Boehringer Ingelheim International GmbH számára. A forgalomba hozatali engedélyt 2004. április 13-án és 2009. április 13-án megújították.
A Beromunra vonatkozó teljes EPAR itt található
Az összefoglaló utolsó frissítése: 4-2009