morfológia
Makroszkopikus szinten változó fokú kortikális atrófia (szövet- vagy szervtömeg csökkentése) figyelhető meg az Alzheimer-kórban, amelyre jellemző a parietális barázdák bővülése, a frontális, időbeli és parietális lebenyeknél. Ezt a atrófiát kompenzálja a kamrai üregek szaporodása, amely a parenchima elvesztése miatt másodlagos (1. ábra). Különösen a betegség előrehaladott stádiumában a mediális temporális lebeny szerkezete, beleértve a hippocampust, az entorhinális kéregt és az amygdala-t, az atrófia súlyosan, mivel azok a patológia korai stádiumából indulnak ki.
Továbbá az Alzheimer-kór mikroszkópos változásokat is jelent, amelyeket extracelluláris szenilis plakkoknak és intracelluláris neurofibrilláris klasztereknek neveznek, amelyek a szövettani diagnózis alapját képezik. A betegség progressziójával tehát súlyos neuronális veszteség van, amelyhez gliózis (neuroglia sejtek körülhatárolt vagy diffúz proliferációja, a természetben reaktív sejtek, azaz az idegszövet támasztó stroma a sejtek képződése) tartozik. ahol a neurofibrilláris plakkok és klaszterek jelenléte nagyobb.
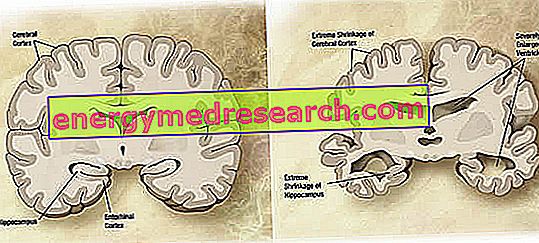
1. ábra : Az agy koronális része: az AD (normál agy és a wikipedia képforrás) által érintett agy és agy közötti különbségek.
Pathogenezis
Az Alzheimer-kór elsősorban két tipikus elváltozással jellemezhető: a szenilis plakkok extracelluláris felhalmozódása, amely főleg a β-amiloid peptid (Aβ) és az intranuronális neurofibrilláris klaszterekből áll, amelyeket hiperfoszforilált tau fehérje alkot.
- A szenilis plakkok az agyterületek szintjén találhatók, mint a hippocampus, az amygdala és a neocortex.
Az Aβ-peptid az amiloidfehérje prekurzor (APP) proteolitikus vágásából származik, p-szekretázzal. Ez a vágás egy 99 maradék terminális karboxifragmentumot (CTF vagy C99) generál, amelyet ezt követően a β-szekretáz vág meg különböző hosszúságú Ap fragmensek előállítására. Ismert, hogy az Aβ leggyakoribb faja az Ap40 fragmens. Egy másik ismert fragmens, amely a proteolitikus vágásból, kevésbé bőséges az Aβ40-ből, az Aβ42, hajlamosabb amiloid fibrillumokat képezni, amelyek az Alzheimer-kórban szenvedő egyén agyában felhalmozódnak.
- Az Alzheimer-kórban jelenlévő másik komponenst neurofibrilláris klaszterek képviselik, amelyek a neuronok citoplazmájában jelenlévő szálakból állnak. A neurofibrilláris klaszterek oldhatatlanok, és úgy tűnik, hogy in vivo rezisztensek a proteolízis folyamatokkal szemben, így a szöveti szekciókban még az idegrendszeri halál után is sokáig maradnak jelen. A szerkezet figyelembevételével a fibrilláris klaszterek kettős spirálszálból és hasonló összetételű lineáris szálból állnak. A kompozíció elemzése során a kettős hélix szálak többnyire hiperfoszforilált tau fehérjéből készülnek. A Tau egy mikrotubulusokhoz tartozó axonális fehérje, amely megkönnyíti az összeállítását.
Az Alzheimer-kórban lévő egyéb fontos neuropatológiai változások közé tartozik a mitokondriális diszfunkció, az oxidatív neuronális károsodás, a szinaptikus veszteség és az axonális degeneráció.
Neurokémiai szempontok
Amint már említettük, az APP-prekurzor proteolitikus vágásából származó Ap-peptid az Alzheimer-kór neurotoxikus komponensét jelenti . Konkrétan feltételezhető, hogy az Aβ fontos lehet a normális agyi funkciókban, és ha bizonyos koncentrációkat leküzd, neurotoxikus lehet. Emellett mind az aggregátumok, mind az Aβ különböző izoformái eltérő biológiai, fiziológiai vagy patológiai szerepet játszhatnak, meghatározhatják és részt vesznek a betegség következő szakaszaiban. Megfigyelték, hogy az Aβ neuromodulátorként hat, befolyásolva bizonyos neurotranszmitterek felszabadulását a neurotoxicitás nyilvánvaló jeleinek hiányában.
Például az Ap neuromoduláló szerepe fiziológiás kontextusban fontos jelentőséggel bírhat a neurotranszmitterrendszer megfelelő egyensúlya szempontjából. Jól ismert, hogy ez a rendszer neurotranszmitterekből, olyan anyagokból áll, amelyek információt közvetítenek az idegrendszert alkotó sejtek, a neuronok között a szinaptikus átvitel útján.
A patológiás körülmények között az Aβ-közvetített szinaptikus transzmisszió a neurotranszmisszió megváltoztatásához vezethet a neurodegeneratív események előtt. Ezeknek a változásoknak a következtében előfordulhatnak korai kognitív és nem kognitív zavarok az érintett neurotranszmitter rendszerek és a különböző érintett agyterületek alapján.
Az Alzheimer-kórban szenvedő egyének agyában a neurotranszmitter rendszerek és a jelátviteli mechanizmus megváltozása nagyon összetett. Az egyik, úgy tűnik, megváltozott rendszer a kolinerg jelátviteli rendszerre vonatkozik, amely magában foglalja az acetil-kolin neurotranszmittert. Valójában kimutatták, hogy az Alzheimer-kórban szenvedő betegek csökkent kolinerg transzmissziót mutatnak a kéreg és a hippocampus szintjén, és fontos agyterületek, amelyek a jelenségek, mint például a tanulás és a memória. Ezen neurotranszmitterek mellett az Alzheimer-kórban a noradrenerg, szerotonerg, valamint a glutamát és a GABA rendszerek változásait figyelték meg.



