Milyen típusú gyógyszer az Otezla - apremilast?
Az Otezla egy olyan gyógyszer, amelyet felnőttek kezelésére használnak:
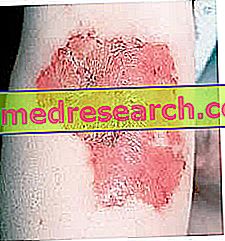
- Mérsékelt vagy súlyos plakk psoriasis (olyan betegség, amely a bőrön vörös hámló foltokat okoz). Olyan betegeknél alkalmazzák, akik nem reagáltak vagy nem tudnak más szisztémás kezeléseket (amelyek az egész testet érintik) psoriasisra, mint például ciklosporin, metotrexát vagy A típusú ultraibolya (PUVA). A PUVA olyan kezelés, amelynek során a beteg egy "psoralen" nevű anyagot tartalmazó gyógyszert kap, és ezt követően ultraibolya fénynek van kitéve;
- aktív pszoriázisos ízületi gyulladás (psoriasishoz kapcsolódó ízületi gyulladás) azoknál a betegeknél, akik nem képesek vagy nem reagáltak megfelelően más, a betegség-módosító antireumatikus gyógyszerek (DMARD-k) nevű gyógyszerekkel történő kezelésére. Az Otezla-t önmagában vagy más DMARD-okkal kombinálva lehet bevenni.
Otezla az apremilast hatóanyagot tartalmazza.
Hogyan alkalmazzák az Otezla-t?
Az Otezla csak receptre kapható, és a kezelést csak a psoriasis vagy a pszoriázisos ízületi gyulladás diagnosztizálásában és kezelésében jártas szakemberek kezdhetik meg. A gyógyszer tabletta formájában kapható (10, 20 és 30 mg). A kezelés az 1. napon 10 mg-os adaggal kezdődik, amelyet fokozatosan egy hét alatt fokozunk a javasolt napi 30 mg-os adagra. Súlyos vesekárosodásban szenvedő betegeknek kisebb adagokat kell adni. A kezelésre adott válaszokat rendszeres időközönként értékelni kell, és az Otezla alkalmazását hat hónap elteltével nem kell javítani. További információ a betegtájékoztatóban található.
Hogyan működik az Otezla - apremilast?
Az Otezla-ban található apremilast hatóanyag blokkolja egy enzim hatását a sejtekben, nevezetesen foszfodiészteráz 4-nek (PDE4). Ez az enzim részt vesz az immunrendszerben (a test természetes védekezésében) lévő citokinek nevében és a gyulladásért és más psoriasis és pszoriázisos ízületi gyulladást okozó folyamatokért felelős molekulák termelésének aktiválásában. A PDE4 blokkolásával az apremilaszt csökkenti a citokinek szintjét a szervezetben, ezáltal csökkentve a gyulladást és a psoriasis és a pszoriázisos ízületi gyulladás egyéb tüneteit.
Milyen előnyei voltak az Otezla - apremilast alkalmazásának a vizsgálatok során?
A psoriasisban az Otezla-t két fő vizsgálatban vizsgálták, összesen 1 257 közepesen súlyos vagy súlyos plakkos psoriasisban szenvedő beteg bevonásával, akiknél az Otezla-kezelést placebóval (hatóanyag nélküli kezelés) hasonlították össze. Mindkét vizsgálatban a hatékonyság fő mércéje a betegek aránya volt, akik 16 hét elteltével reagáltak a kezelésre. A kezelési választ úgy határoztuk meg, hogy a psoriasis-térség súlyossági indexe (PASI-75) néven ismert tünetek 75% -át vagy annál nagyobb mértékű csökkenését értjük. A két vizsgálatban az Otezla-val kezelt betegek közül 33% (168-ből 562-ből) és 29% -aa (79-ből 274-ből) reagált a kezelésre, szemben az 5% -kal (15-ből 282-re) és 6% -kal (8-ból 137). ) a placebóval kezeltek közül. A pszoriázisos ízületi gyulladás esetében az Otezla-t placebóval hasonlították össze három fő vizsgálatban, amelyekben a korábbi kezelés ellenére 1 493 aktív betegségben szenvedő beteg vett részt. Azok a betegek, akik már szedtek más, „kis molekulatömegű DMARD-k” nevű gyógyszereket, mint például a metotrexát, folytatták ezt a kezelést a vizsgálat során. A hatásosság fő mércéje egy olyan pontszám 20% -os javulása volt, amely 16 hetes kezelés után olyan tüneteket mér, mint a duzzadt és fájdalmas ízületek (ACR-20). Ez a javulás a három vizsgálatban a jóváhagyott Otezla-dózissal kezelt betegek 32 és 41% -a között alakult ki, míg a placebót kapók 18-19% -ánál. Az előny mind az egyedül Otezla-val kezelt betegeknél, mind azoknál, akik más DMARD-eket is kaptak. Mind a pikkelysömör, mind a pszoriázisos ízületi gyulladás esetén a kezelés meghosszabbításával járó haszon fenntartása (32 és 52 héten át) kimutatható volt.
Milyen kockázatokkal jár az Otezla - apremilast alkalmazása?
Az Otezla leggyakoribb mellékhatásai (amelyek 10-ből több mint 1-et érinthetnek) az emésztőrendszerre gyakorolt hatások, például hasmenés és hányinger (rosszullét). Ezek a hatások általában a kezelés első két hetében jelentkeznek, és négy héten belül javulnak. A többi gyakori mellékhatás (amely 10-ből legfeljebb 1-et érinthet) a felső légúti fertőzések (megfázás), fejfájás vagy feszültség-fejfájás. Az Otezla nem alkalmazható terhesség alatt, és a fogamzóképes nőknek hatékony fogamzásgátlást kell alkalmazniuk a kezelés alatt. Az Otezla-val kapcsolatos összes mellékhatás és korlátozás teljes listáját lásd a betegtájékoztatóban.
Miért engedélyezték az Otezla - apremilast alkalmazását?
Az Ügynökség emberi felhasználásra szánt gyógyszerek bizottsága (CHMP) úgy döntött, hogy az Otezla előnyei meghaladják a kockázatokat, és azt javasolta, hogy az EU-ban engedélyezhető legyen. A CHMP a psoriasis és a pszoriázisos ízületi gyulladás előnyeit bizonyította. Bár a gyógyszert nem hasonlították össze más engedélyezett kezelésekkel, és a pszoriázisos ízületi gyulladás nem mutatott radiológiai bizonyítékot a betegség előrehaladására, főként enyhe vagy mérsékelt mellékhatásokra és arra a tényre, hogy a gyógyszert lehet szedni. az orális adagolás elfogadhatóbbá teheti a betegeket. A bizottság ezért hasznosnak ítélte a másodlagos kezelést azoknál a betegeknél, akik nem reagálnak, vagy nem használhatják az első vonalbeli kezelést.
Milyen intézkedéseket hoznak az Otezla - apremilast biztonságos és hatékony használatának biztosítása érdekében?
Kockázatkezelési tervet dolgoztak ki annak érdekében, hogy az Otezla-t a lehető legbiztonságosabban használják fel. E terv alapján az Otezla termékjellemzői és a betegtájékoztató tartalmazza a biztonsági információkat, beleértve az egészségügyi szakemberek és a betegek által követendő megfelelő óvintézkedéseket. További információ a kockázatkezelési terv összefoglalójában található.
További információ az Otezla - apremilastról
2015. január 15-én az Európai Bizottság kiadta az egész Európai Unióban érvényes Otezla forgalomba hozatali engedélyét. Az EPAR teljes változata és az Otezla kockázatkezelési tervének összefoglalója az Ügynökség honlapján olvasható: ema.Europa.eu/Find medicine / Emberi gyógyszerek / Európai nyilvános értékelési jelentések. Az Otezla-kezeléssel kapcsolatos további információkért olvassa el a (szintén az EPAR részét képező) betegtájékoztatót, vagy forduljon orvosához vagy gyógyszerészéhez. Az összefoglaló utolsó frissítése: 01-2015